Принципы отбора тем
 Взяты статьи по биологии/биотехнологиям/медицине, отобранные индексатором научных публикаций Web Of Science по следующим критериям:
Взяты статьи по биологии/биотехнологиям/медицине, отобранные индексатором научных публикаций Web Of Science по следующим критериям:
— публикации вышли в
— их раздел «topic» содержит термины «perspective therapy», «breakthrough therapy», «new therapeutic modalities» и подобные,
— публикации были отсортированы по цитируемости (за всё последующее с выхода время) в источниках, включённых в Web Of Science Core Collection — и именно самые цитируемые работы определили список тем для нашего рассмотрения.
РНК-интерференция
Ожидания
Открытие в конце
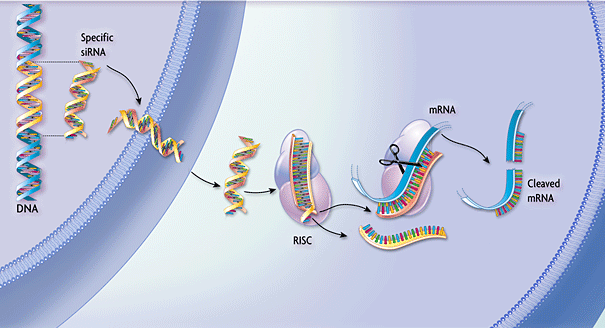
Рисунок 1. Схематическое изображение
Впоследствии были выявлены серьёзные проблемы с целевой доставкой
Решение, выглядящее очень перспективным, было подобрано довольно быстро — использование вирусных носителей, специфически «нацеленных» на нужные клетки.
Другой способ — упаковка РНК в наношарики, которые защищали бы её от разрушения ферментами и обеспечивали проникновение в клетки.
Однако большинством препаратов, дошедших до фазы 3 клинических исследований, были обычные молекулы РНК, защищённые от деградации ферментами химической модификации.
Реальность
Дальше разработчиков ждало разочарование за разочарованием. Оказалось, что
Возможно, в будущем проблемы с неспецифичным связыванием РНК и недостаточно адресной доставкой будут решены и мы увидим больше специфических препаратов на основе RNAi.
Наглядный материал
Магнитные наночастицы в терапии раковых опухолей
Ожидания
Вскоре после технологических прорывов, позволивших создавать объекты наномасштаба и оперировать ими, выяснилось, что наночастицы — особенно оксиды железа и некоторых других металлов — обладают высочайшей проникающей способностью в отношении клеток живых организмов. Предполагалось, что раковые клетки способны к более активному — в сравнении со здоровыми клетками — поглощению таковых частиц. Если частицы изготовлены из проводящего материала, то последующее воздействие мощного высокочастотного электромагнитного поля вызывает сильный нагрев частиц, что разрушает содержащие их клетки. Следует отметить, что нагрев нежелательных клеток/тканей — так называемая гипертермия — и раньше использовался в клинической практике, в том числе, в онкологии, но именно с появлением наноматериалов этот метод терапии стал выглядеть очень перспективным.
Реальность
На сегодняшний день можно констатировать, что этот подход пока не вызвал революцию в лечении рака. Как это часто бывает, результаты исследований на клетках и на животных плохо переносятся на человека, хотя некоторые успехи в ранних клинических исследованиях и были достигнуты:
Главной проблема клинического применения оказалась неизбирательность проникновения наночастиц в опухоль, неравномерное или неполное проникновение частиц в опухоль и сложность стандартизации самой процедуры. Оказалось, что для избирательной доставки частиц в опухоль недостаточно просто ввести их в кровоток, нужно либо вводить их прямо в опухоль, либо снабжать антителами, которые адресно направят их в опухоль. И то, и другое улучшение обладает своими недостатками и прибавляет сложности процедуре.
В итоге на настоящий момент другие способы лечения рака, о некоторых из которых речь пойдёт ниже, оказались более перспективными и развиваются быстрее.
Наглядный материал
Гуманизированные антитела
Далее представлены несколько терапевтических решений, объединённых единством подхода: после выбора конкретной белковой мишени, чья функция важна в регуляции биохимии некоторого заболевания, к этому белку подбираются антитела, то есть тоже белковые молекулы, специфически связывающиеся с мишенью, блокирующие её функцию, меняющие ход биохимических реакций и — в идеале — останавливающие развитие болезни.
Попытки лечить различные патологии антителами предпринимались начиная с
Антитела к VEGF
Ожидания
Бевацизумаб, препарат, впоследствии получивший медицинское название Авастин (Avastin), был плодом попыток заблокировать активность белка — эндотелиального фактора роста сосудов (vascular endothelial growth factor, VEGF), давно выбранного учёными в качестве перспективной мишени в терапии рака. Дело в том, что упомянутый белок является ключевым регулятором роста сосудов, ангиогенеза — а этот процесс активно идёт при развитии и метастазировании раковых опухолей.
Реальность
Препарат после выхода на рынок стал «блокбастером» (то есть его ежегодные продажи превысили $1 млрд) и вошёл в стандарты терапии ряда онкологических заболеваний поздней стадии: рака толстой и прямой кишки, лёгкого, почки, яичника, молочной железы и некоторых других. Исследования Авастина в различных сочетаниях активно продолжаются. Однако сейчас уже понятно, что, несмотря на то, что у части пациентов Авастин вызывает остановку роста опухоли или даже её регресс, затем у некоторых их них наступает мощный рецидив, который уже ничем не лечится. Видимо, под действием Авастина в опухоли, лишённой питательных веществ, происходит отбор наиболее злокачественных популяций раковых клеток. Кроме того, применение Авастина связано с довольно тяжёлыми побочными эффектами (так как VEGF играет роль в нормальном функционировании кровеносных сосудов и залечивании ран) — тромбозами, гипертонией и кровотечениями, особенно в
Антитела к EGFR
Ожидания
Рецептор эпидермального фактора роста (epidermal growth factor receptor, EGFR) стал мишенью для терапии рака, когда выяснилось, что сверхэкспрессия или просто повышенная активность этого белка (например, вследствие мутаций) посылает в клетки сигнал о неограниченном делении, и что именно такой сигнальный каскад активирован во многих типах рака. Первым широко используемым
Реальность
Эрбитукс и его более поздний аналог Panitumumab (Vectibix, Вектибикс) заняли довольную большую нишу в терапии раков, экспрессирующих EGFR, — в первую очередь, при раке головы и шеи, а также при раке толстой и прямой кишки. Этот подход оказался неэффективным при терапии рака лёгкого и поджелудочной железы. Применение
Антитела к HER2
Ожидания
Белок Her2 — тирозиновая протеинкиназа рецептора эпидермального фактора роста — играет ключевую роль во множестве клеточных сигнальных каскадов, а дисбаланс этих каскадов может привести к развитию некоторых типов рака. В
Реальность
Герцептин стал блокбастером благодаря своей эффективности в лечении рака молочной железы, экспрессирующего HER2, однако у него есть и недостатки: на лечение отвечают далеко не все пациентки, его применение способно вызвать сердечную недостаточность, и со временем у многих вырабатывается устойчивость к препарату и опухоль снова начинает расти — происходит отбор на клетки, не экспрессирующие HER2. Тем не менее, Герцептин стал большим шагом вперёд по сравнению с обычной химиотерапией, позволив продлить жизнь многим пациенткам и улучшив её качество.
TNF-alpha (TNFα) и воспалительные заболевания
Ожидания
Как оказалось, белок, носящий название «фактор некроза опухоли — альфа» (Tumor Necrosis Factor alpha,
Начиная с
Реальность
Все они также получили регистрацию по псориазу, а Ремикейд и Хумира — ещё и по воспалительным заболеваниям кишечника. Упомянутые заболевания относятся к аутоиммунным — то есть иммунная система организма атакует его собственные белки, что приводит к хроническому воспалению и повреждению тканей и органов. В случае ревматоидного артрита повреждаются в основном суставы, в случае псориаза — кожа, а воспалительные заболевания кишечника поражают толстый и тонкий кишечник. Все их объединяет присутствие повышенных количеств
Все
Наглядный материал
Иматиниб
Ожидания
Препарат, известный также под названием «Гливек», стал воплощением парадигмы так называемого «рационального дизайна лекарств». Этот подход стал возможен относительно недавно, с новым витком развития молекулярной биологии, физики и химии. Суть его в следующем: зная детали биохимических каскадов в клетках и участвующих в них белковых агентов, возможно подобрать структуру вещества так, чтобы оно связывалось с конкретными
Реальность
Создание Гливека позволило перевернуть терапию тяжёлых онкологических заболеваний крови, например, хронической миелогенной лейкемии и острого лимфобластного лейкоза. Эти заболевания возникают
Наглядный материал
Рапамицин
Ожидания
Появившись под названием Сиролимус (Sirolimus), этот препарат природного (бактериального) происхождения изначально использовался как противогрибковый. Но впоследствии спектр его потенциальных активностей сильно расширился. В 2000 гг. исследователи обратили внимание на способность рапамицина подавлять ангиогенез — рост сосудов. Этот процесс особенно интенсивно идёт в раковых опухолях. Как выяснилось, рапамицин, ингибируя внутриклеточный белок mTOR, блокирует активность ключевого белка ангиогенеза, уже упомянутого нами ранее белка VEGF, а также угнетает активность иммунной системы. Это открыло перспективы использования рапамицина и его производных в качестве антираковых и иммуносупрессорных препаратов, в первую очередь при трансплантации, раке молочной железы, раке почки, лимфомах.
Реальность
В последние годы звучат громкие слова о достоверном эффекте продления жизни лабораторных животных с помощью этого препарата — но никаких результатов аналогичных испытаний на людях нет, что вкупе с известными побочными эффектами препарата (подавление иммунной системы, онкологические риски) даёт основания исследователям предостерегать от его использования в качестве «эликсира жизни».
Амфотерицин B и лихорадка
Ожидания
Амфотерицин B, антибиотик природного происхождения, был выделен и исследован ещё в
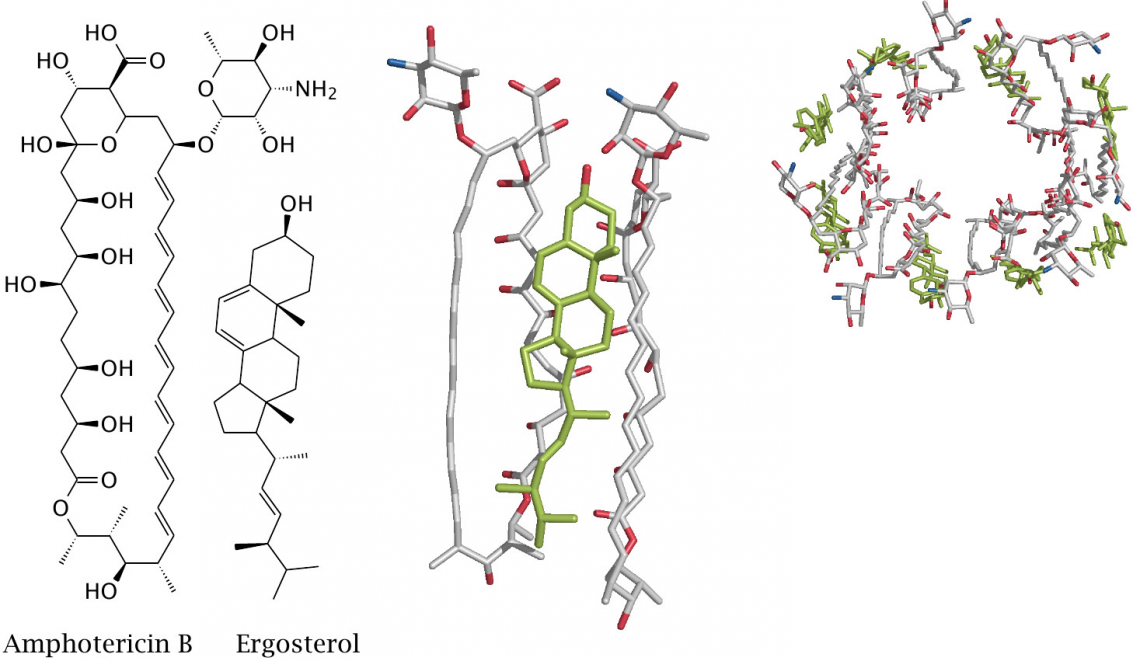
Рисунок 2. Комплекс амфотерицина B и эргостерола образует кольцевую структуру, которая, встраиваясь в мембрану клетки, создаёт в ней ионный канал.
Реальность
Несмотря на широкий список жизнеугрожающих побочных эффектов (особенно часто случаются почечная токсичность и полиорганная недостаточность), амфотерицин B и сейчас остаётся единственным средством лечения ряда системных и наиболее опасных грибковых инфекций. Позднее была разработана липосомальная форма амфотерицина B — распространённая стратегия улучшения лекарственных препаратов, состоящая в том, что молекула «упаковывается» в липосомы — шарики из липидов, внутри которых находится лекарство. Такое изменение позволило несколько снизить побочные эффекты и повысить эффективность при лечении ряда инфекций.
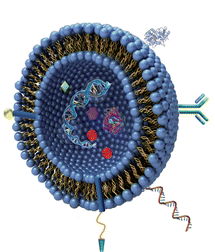
Рисунок 3. Липосома в разрезе. Липосомы довольно часто используются для упаковки лекарств, так как это позволяет предохранить их от разрушения в крови и улучшить доставку в клетки. Липосомы снаружи иногда модифицируют молекулами для более адресной доставки только в нужные клетки.
Наглядный материал
Интерфероны
Ожидания
Интерфероны были открыты в середине 20 века, и на них долгое время возлагали большие надежды как на средства лечения рака, вирусных инфекций и воспалительных заболеваний. По мере прогресса биологии и медицины стало понятно, что под названием «интерфероны» объединяются белки разных типов, однако все они выполняют сигнальную функцию при защите организма от чужеродных объектов.
Свойство интерферонов активировать иммунный ответ и приводить к уменьшению опухолей у животных, снижать у искусственно заражённых животных количество вирусных частиц дало повод утверждать, что найдено универсальное лекарство от рака и вирусных заболеваний. Конечно, как часто бывает, столь категорические заявления оказались преждевременными.
Реальность
По мере исследования действия интерферонов на людях стало понятно, что как одиночные агенты они помогают далеко не всем. Кроме того, постоянное применение интерферонов невозможно, так как они вызывают эффекты, подобные гриппу и другие нежелательные явления. Если при кратковременной терапии с такими эффектами можно смириться, то для долговременного лечения, например, воспалительных заболеваний, такой препарат не подходит. Сейчас интерфероны всё ещё применяются при лечении вирусных гепатитов B и C, рассеянного склероза, некоторых видов рака, однако по мере того, как на рынок выходят всё более безопасные и эффективные лекарства, интерфероны уступают им дорогу как слишком неизбирательные.
Наглядный материал
Заключение
Рассмотренные примеры далеко не исчерпывающие — за рамками остались такие интересные и широкие темы, как тромболитики и антиоксиданты, на которые возлагали большие и не оправдавшиеся надежды при лечении инсульта; иммунотерапия рака, которая, наконец, дала реально работающие лекарства, совершившие прорыв в лечении меланомы и рака лёгких (и обещающая ещё больше); стволовые клетки, которые пока так и не позволили добиться реальных успехов. Этим темам мы постараемся посвятить следующие аналогичные обзоры.
Однако и приведённых примеров достаточно, чтобы убедиться: наибольших успехов разработка лекарств достигает в тех областях, где заложен солидный научный фундамент, где понимание механизмов развития патологий позволяет предположить, что может на них повлиять, создать модельных животных, понять, как построить программу исследований на людях. И наоборот, недостаточное понимание в настоящее время того, как работает мозг, иммунная система, как прогрессирует рак, приводит к слепым и бесплодным попыткам «нащупать» лекарство, которое по счастливой случайности сработает при болезни Альцгеймера или раке желудка. При этом, как уже говорилось выше, особенно спекулятивно звучат высказывания некоторых учёных и вообще специалистов в биомедицине и фармакологии, которые, едва открыв
Надеемся, что эта статья поможет читателем более трезво относиться к таким смелым прогнозам, но и даст повод для оптимизма в отношении прогресса биомедицины в будущем.
Авторы — Илья Ясный и Пётр Власов.
Источник: http://22century.ru/docs/biomed


